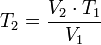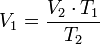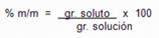Química
Orgánica
•Es la ciencia que estudia la estructura y propiedades de los
compuestos del carbono que constituyen principalmente la materia viva, su
aplicación a la industria y al desarrollo tecnológico.
•Es llamada también Química de los Compuestos del Carbono
DIFERENCIAS ENTRE COMPUESTOS ORGÁNICOS
E INORGÁNICOS:
COMPUESTOS
ORGÁNICOS
•Esta formado
principalmente por : C, H, O, N
•El numero de
compuestos orgánicos excede considerablemente al número de compuestos
inorgánicos .
•Entre los compuestos
orgánicos prevalece el enlace covalente.
•Los compuestos
orgánicos son generalmente insolubles en agua debido a su baja polaridad.
•Los compuestos
orgánicos son sensibles al calor, es decir, se descomponen fácilmente.
•Los cuerpos orgánicos
reaccionan entre si lentamente debido al enlace covalente.
•Las sustancias
orgánicas al disolverse no se ionizan, por lo tanto sus moléculas no conducen a
la electricidad.
•Los cuerpos orgánicos
son inestables aún a bajas temperaturas frente al calor y la luz.
COMPUESTOS
INORGÁNICOS
•Están constituidos por
átomo de cualquier elemento.
•Resisten a la acción
del calor.
•Los compuestos
inorgánicos prevalece el enlace ionico.
•Los compuestos
inorgánicos son solubles al agua debido a su elevada polaridad
•pero insolubles en
disolventes orgánicos.
•Los compuestos cuando
se encuentran en solución son buenos conductores del calor y la electricidad.
•Los compuestos
inorgánicos poseen reacciones instantáneas.
•Las moléculas
inorgánicas son menos complejas que los compuestos de carbono, debido a su bajo
peso molecular.
•Los compuestos
inorgánicos son estables a las condiciones de temperaturas altas.
Los principales grupos funcionales
son los siguientes:
Grupo hidroxilo (– OH)
Es
característico de los alcoholes, compuestos constituidos por la unión de dicho
grupo a un hidrocarburo (enlace sencillo).
Grupo alcoxi (R
– O – R)
Grupo
funcional del tipo R-O-R', en donde R y R' son grupos que contienen átomos de
carbono, estando el átomo de oxígeno en medio de ellos, característico de los
éteres (enlace sencillo). (Se usa la R ya que estos grupos de átomos
constituyen los llamados RADICALES
Grupo carbonilo (>C=O)
Su
presencia en una cadena hidrocarbonada (R) puede dar lugar a dos tipos
diferentes de sustancias orgánicas: los aldehídos y las cetonas.
En
los aldehídos el grupo C=O está unido por un
lado a un carbono terminal de una cadena hidrocarbonada (R) y por el otro, a un
átomo de hidrógeno que ocupa una posición extrema en la cadena. (R–C=O–H)
(enlace doble).
En
las cetonas, por el contrario, el grupo
carbonilo se une a dos cadenas hidrocarbonadas, ocupando por tanto una
situación intermedia. (R–C=O–R) (enlace doble).
HIDROCARBUROS
Masa atómica: masa atómica(m. a.),
es la suma de sus protones y neutrones y varía en los distintos elementos de la
tabla periódica.
Masa molecular: Se calcula sumando las
masas atómicas de los elementos que componen la molécula. Así, en el caso del
agua: H2O, su masa molecular es:
H=2 x 1,00007 + O=
15.9999 = 16 u (Uma)
Mol: Un mol es la cantidad
de materia que contiene 6,02 x 1023 partículas elementales (ya sea átomos, moléculas, iones,
partículas subatómicas, etcétera) en 12
gramos de Carbono. También se llama
Número de Avogadro. Por ejemplo, una mol de etanol es igual a 6.023 × 10 23 moléculas de etanol.
HIPÓTESIS DE AVOGADRO
Los
átomos son demasiado pequeños para permitir medidas significativas de
sustancias químicas. Para trabajar con cantidades significativas de sustancias,
los científicos las agrupan en unidades llamadas moles. Un mol es definido como
el número de átomos de carbono en 12 gramos de un isótopo de carbón-12, el cual
es 602,2 sextillones
(6,022 por 10 a la potencia 23) de átomos. Este número es llamado número de
Avogadro o constante de Avogadro. Es usado como el número de átomos para
cualquier sustancia y la masa de 1 mol de una sustancia es su masa molar.
PASOS
PARA CALCULAR MOLES:
1.Identifica
el
compuesto o elemento que debas convertir a moles.
2.Encuentra
el elemento en la tabla periódica.
3.Anota
el peso atómico del elemento.
Por lo general, éste es el número que se encuentra en la parte inferior, por
debajo del símbolo del elemento. Por ejemplo, el peso atómico del helio es
4,0026. Si debes identificar la masa molar de un compuesto, debes sumar todos
los pesos atómicos de cada elemento del compuesto.
4.Multiplica
el número de gramos del elemento/compuesto por la fracción 1/masa molar. Esto es 1 mol dividido por los
pesos atómicos que acabas de obtener. Puedes expresar esto como una fracción
del número de gramos por 1 mol dividido por la masa molar, o “compuesto g x
1/masa molar (g/mol) = moles”.
5.Divide
ese número por la masa molar.
El resultado es el número de moles de tu elemento o compuesto. Por ejemplo,
imagina que tienes 2 g de agua, o H20, y quieres convertirlo a moles. La masa
molar del agua es 18 g/mol. Multiplica 2 veces 1 para obtener 2. Divide 2 por
18, y tienes 0,1111 moles de H20.
EJEMPLOS: CÁLCULO DE MOLES
¿Cuántas
moles de hierro representan 25.0 g de hierro (Fe)?
Necesitamos convertir gramos de Fe a moles de Fe. Buscamos la masa atómica del Fe y vemos que es 55.85 g . Utilizamos el factor de conversión apropiado para obtener moles.
Necesitamos convertir gramos de Fe a moles de Fe. Buscamos la masa atómica del Fe y vemos que es 55.85 g . Utilizamos el factor de conversión apropiado para obtener moles.
¿Cuántos
átomos de magnesio están contenidos en 5.00 g de magnesio (Mg)?
Necesitamos convertir gramos de Mg a átomos de Mg. Para este factor de conversión necesitamos la masa atómica que es 24.31 g.
Necesitamos convertir gramos de Mg a átomos de Mg. Para este factor de conversión necesitamos la masa atómica que es 24.31 g.
COMPOSICIÓN PORCENTUAL
FÓRMULA EMPÍRICA Y MOLECULAR
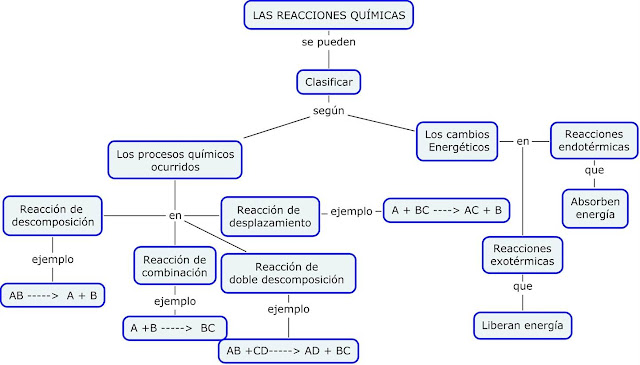
REACCIONES QUÍMICA
Reacciones de la química inorgánica[
Desde un punto de vista de la química inorgánica se pueden postular dos grandes modelos para las reacciones químicas de los compuestos inorgánicos: reacciones ácido-baseo de neutralización (sin cambios en los estados de oxidación) y reacciones redox (con cambios en los estados de oxidación). Sin embargo, podemos clasificarlas de acuerdo con el mecanismo de reacción y
tipo de productos que resulta de la reacción. En esta clasificación
entran las reacciones de síntesis (combinación), descomposición, de
sustitución simple, de sustitución doble:
| Nombre | Descripción | Representación | Ejemplo |
|---|---|---|---|
| Reacción de síntesis | Elementos o compuestos sencillos que se unen para formar un compuesto más complejo.
La siguiente es la forma general que presentan este tipo de reacciones:
| A+B → AB
Donde A y B representan cualquier sustancia química.
Un ejemplo de este tipo de reacción es la síntesis del cloruro de sodio:
| 2Na(s) + Cl2(g) → 2NaCl(s) |
| Reacción de descomposición | Un compuesto se fragmenta en elementos o compuestos más sencillos. En este tipo de reacción un solo reactivo se convierte en zonas o productos. | AB → A+B
Donde A y B representan cualquier sustancia química.
Un ejemplo de este tipo de reacción es la descomposición del agua:
| 2H2O(l) → 2H2(g) + O2(g) |
| Reacción de desplazamiento o simple sustitución | Un elemento reemplaza a otro en un compuesto. | A + BC → AC + B
Donde A, B y C representan cualquier sustancia química.
Un ejemplo de este tipo de reacción se evidencia cuando el hierro(Fe) desplaza al cobre(Cu) en el sulfato de cobre (CuSO4):
| Fe + CuSO4 → FeSO4 + Cu |
| Reacción de doble desplazamiento o doble sustitución | Los iones en un compuesto cambian lugares con los iones de otro compuesto para formar dos sustancias diferentes. | AB + CD → AD + BC
Donde A, B, C y D representan cualquier sustancia química.
Veamos un ejemplo de este tipo de reacción:
| NaOH + HCl → NaCl + H2O |
BALANCEO DE ECUACIONES QUÍMICAS
Una reacción química es la
manifestación de un cambio en la materia y la representación de un fenómeno
químico. A su expresión escrita se le da el nombre de ecuación
química, en la cual se expresa los
reactivos a la izquierda y los productos de la reacción a la derecha, ambos
separados por una flecha.
Más exactamente, a la izquierda del
símbolo indicamos el contenido inicial del sistema en reacción (reactivos), y a
la derecha el contenido del sistema final (productos). Cada sustancia se
representa por su fórmula química, y posteriormente debemos ajustar toda
la ecuación.
Para equilibrar o balancear
ecuaciones químicas, existen diversos métodos. En todos, el objetivo que se
persigue es que la ecuación química cumpla con la ley de la conservación de la
materia.
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa
de los reactivos" por lo tanto "La materia no se crea ni se destruye,
solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes
denominados "Coeficientes" a la derecha del compuesto o elemento del que
se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y
(hablar de oxidación se refiere a que un elemento pierda electrones y su
valencia aumente) el otro se reduce (cuando el elemento gana electrones
y su valencia disminuye) para éste método se siguen los siguientes
pasos o reglas:
- 1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
- 2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
- 3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
- 4. Los alcalinos tienen en sus compuestos oxidación +1
- 5. Los alcalinotérreos tienen en sus compuestos oxidación +2
- 6. Los alógenos tienen en sus compuestos con aluros oxidación -1
- 7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
- 8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
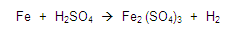
Si vemos la primera regla, esta nos dice que todos los elementos libres
tendrán valencia cero, entonces vemos la ecuación y localizamos a los
elementos libres, en este caso son el fierro y el hidrógeno, colocamos
un cero como valencia.
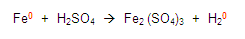
Continuamos con las demás reglas y encontramos a los oxígenos e
hidrógenos y les asignamos la valencia que les corresponde, establecidas
en las reglas:
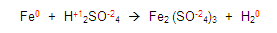
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
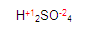
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí)
vamos a multiplicar la valencia del oxígeno por el número de oxígenos
que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el
hidrógeno, multiplicamos su valencia por el número de oxígenos que hay.
Queda de la siguiente manera
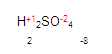
Ya que tenemos los resultados, ahora verificamos que todo elemento
químico es eléctricamente neutro y lo comprobamos de la siguiente
manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho.
Entonces encontramos que faltan 6, este número será colocado con signo
positivo +
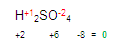
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
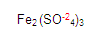
Localizamos al fierro. Para obtener su valencia primero denominamos si
es monovalente o divalente etc. Ya que vimos que es divalente,
necesitamos saber la valencia del radical sulfato, en este caso es
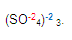
Para obtener la valencia del fierro, multiplicamos la valencia del
radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya
tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia
del azufre (S) lo cual realizaremos algo similar con lo dicho con
anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y
después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia
del fierro es 3 entonces multiplicamos la valencia por el numero de
fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
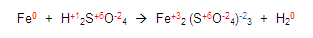
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para
esto, chequemos las valencias de los elementos, debemos verificar que en
los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo.
Encontramos que sus valencias ya no son las mismas por tanto el elemento
se está oxidando porque aumenta su valencia de cero a 3
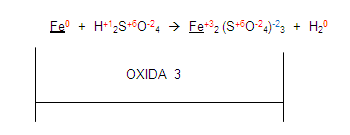
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
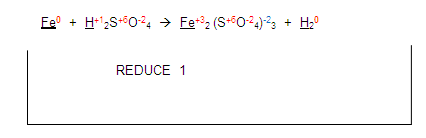
Entonces la ecuación queda de la siguiente manera:
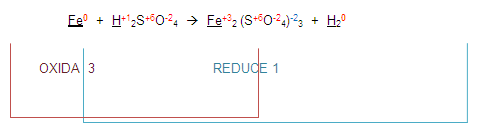
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
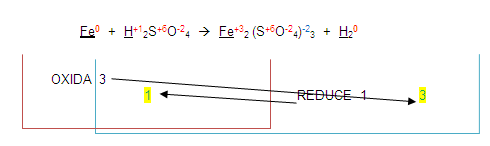
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
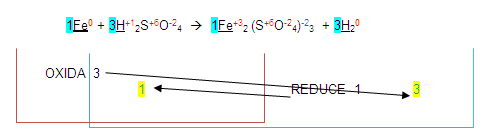
Entonces de esta manera podemos deducir que la ecuación está balanceada,
pero, no es así, uno de los pasos para terminarla es: "Una vez
obtenidos los números de la ecuación, se completará con método de
tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
Con este insignificante 2 que acabos de encontrar en el fierro del
segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos
lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
BALANCEO POR EL MÉTODO ALGEBRAICO/MATEMATICO
Se siguen los siguientes pasos:
- Escribir sobre cada molécula una literal, siguiendo el orden alfabético.
- Enlistar verticalmente los átomos que participan en la reacción
- A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encentra en cada molécula identificada por letra.
- Si de un lado de la reacción un elemento se encuentra en mas de una molécula, se suman y se escribe cuantas veces está presente en una molécula
- Se cambia la flecha por un signo igual =
- Se enlistan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno
- Los valores de las letras se obtienen por operaciones algebraicas
Ejemplo:
Balancear la siguiente ecuación:

Aplicamos el segundo paso:
Ca
C
O
H
Continuamos con el tercer paso:
Ca: (Ca está en "a" del primer miembro y en "c" en el segundo por lo tanto) a=c
C: (C está 2 veces en "a" y 2 veces en "d" por lo tanto) 2a = 2d
O: (O está en "b" y 2 veces en "c" por lo tanto) b = 2c
H: (H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto) 2b = 2c + 2d
Le asignaremos el valor de "1" a C

ESTEQUIOMETRÍA
La estequiometria es el área de la química que
estudia la relación entre las moléculas de reactantes y productos dentro de una
reacción química.
Como sabemos, para que se forme un
compuesto debe haber una separación, combinación o reordenamiento de los
elementos, lo que se puede ilustrar por medio de una reacción, la cual
representa el proceso que ocurrió para que un determinado reactante llegara a
ser un producto.
Reactantes
→Productos
LEY DE LAS PROPORCIONES DEFINIDAS
(Louis
Joseph Proust 1754-1826). En la formación de un compuesto, la proporción
de elemento que se combina con una masa definida de otro elemento, será siempre
la misma, es decir, cada compuesto químico, contiene siempre los mismos
elementos unidos en idénticas proporciones.
por
ejemplo, del cloruro sódico indica que para formar 5 g de cloruro sódico, se
necesitan 3 g de cloro y 2 g de sodio, por lo que la proporción entre las masas
de ambos elementos es:
Si hacemos reaccionar ahora 10 g de cloro,
como se calcular cuántos g de sodio se necesita y cuál es la proporción entre
las masas:
LEY DE LAS PROPORCIONES MÚLTIPLES
(Jonh
Dalton).
"Las
cantidades variables de un mismo elemento que se combinan con una cantidad fija
de otro para formar dos o más compuestos distintos, se encuentran en una
relación numérica sencilla".
Un ejemplo
de aplicación de la ley de Dalton es el siguiente: 16 g de oxígeno pueden
combinarse con 14 g de nitrógeno para producir monóxido de nitrógeno, o con 7 g
de nitrógeno para formar dióxido de nitrógeno. Se obtiene una relación de
números enteros sencilla entre las cantidades variables de nitrógeno que se
combinan con una misma cantidad de oxígeno. 7:14 = 1:2
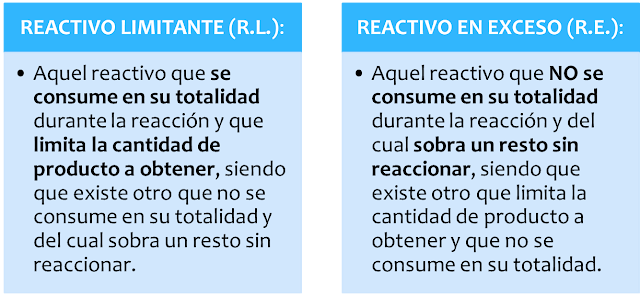
REACTIVO LIMITANTE
y REACTIVO EN EXCESO
El reactivo
limitante es aquel que limita la reacción. Es decir: una vez que este reactivo
se acaba, termina la reacción. El reactivo que sobra se llama reactivo
excedente. Por lo tanto, la cantidad de producto que se forme depende de la
cantidad de reactivo limitante. Este depende de la reacción y es distinto para
cada una de ellas.
Por ejemplo: Si debemos hacer
sándwich de queso, y para ello disponemos de siete panes y sólo cinco láminas
de queso, ¿cuántos sándwiches podré hacer? Sólo
podré hacer cinco sándwiches, y por
tanto las láminas de queso serán el reactivo limitante de este proceso,
mientras que el pan será el reactivo excedente.
REACTIVO LIMITANTE
y REACTIVO EN EXCESO
Pasos:
1.Igualar la ecuación
2.Calcular UMA
3.Calcular moles
4.Dividir
los moles obtenidos para el coeficiente molar
El
compuesto con menor número de moles será el reactivo limitante y el mayor será
el reactivo en exceso.
A
partir de los moles obtenidos del reactivo limitante, se busca mediante regla
de tres el valor de moles del otro reactivo.
Para
calcular el exceso se trabaja con los moles del compuesto en exceso menos el
valor obtenido de la regla de tres
Para calcular la masa del exceso se multiplica
los moles por la UMA
EJEMPLO:
Si tengo
15 moles de hidrógeno y 10 moles de nitrógeno, ¿cuál será el reactivo
limitante, cuál el reactivo en exceso, y cuántos moles de amoníaco se podrán obtener?
Lo primero
que debemos hacer es ajustar la reacción, es decir, colocar los coeficientes
estequiométricos adecuados, para que el número de átomos en los reactivos sea
igual al número de átomos en los productos, y de esta manera cumplir con la ley
de conservación de la materia.
Entonces la reacción ajustada (al
tanteo), quedará de la siguiente manera:
3H2
+ N2 = 2NH3
Esto se interpreta así: 3 moléculas
o moles de hidrógeno reaccionan con una molécula o mol de nitrógeno para
obtener 2 moles o moléculas de amoníaco.
Entonces, si tengo 15 moles
de hidrógeno, reaccionarán con 5 moles de nitrógeno, sobrando otros 5
moles de este elemento. Por lo tanto en este caso, el hidrógeno es el reactivo
limitante, y el nitrógeno, el reactivo en exceso. Si con tres moles de
hidrógeno se producirían dos moles de amoníaco, con 15 moles de hidrógeno
obtendremos 10 moles de amoníaco.
PORCENTAJE DE RENDIMIENTO
PORCENTAJE DE RENDIMIENTO
*Sirve
para determinar la eficiencia de una reacción específica. Se obtiene del:
Rendimiento experimental (real) x 100
Rendimiento
teórico
Rendimiento experimental es el
que se obtiene después de un proceso de reacción, que se puede ver afectado por
factores como la presión, temperatura, cantidades de reactivos, la pureza, etc.
Rendimiento teórico: se calcula a
partir del reactivo limitante
PASOS PARA CALCULAR PORCENTAJE DE RENDIMIENTO
1.
Balancear la reacción
2.
Convertir a moles todas las cantidades
3.
Determinar el reactivo limitante
4.
Calcular el rendimiento teórico
5.
Identificar el rendimiento experimental
6.
Calcular el porcentaje de rendimiento
% PUREZA
Algunas reacciones trabajan con
sustancias puras, lo que quiere decir que hay que eliminar las impurezas
sobretodo cuando se trata de sustancias minerales.
Con frecuencia en los
laboratorios e industrias reactivos que se emplean presentan impurezas y
esto afecta la calidad del producto, el cual no se obtendrá en estado puro.
Como las relaciones estequiométricas se basan en sustancias puras es
necesario estar seguros de que las cantidades tomadas para los cálculos
correspondan a material puro que se encuentra en los reactivos con impurezas.
La cantidad sustancia
pura (SP)
de una sustancia
impura (SI)
se puede calcular de la siguiente manera:
SP = (SI x %Pureza)/100
GAS IDEAL
Es
aquel que cumple exactamente con las leyes establecidas para los gases, es
decir, un gas donde no hay fuerzas de atracción o repulsión entre las moléculas
y el cual el volumen real de las moléculas es insignificante.
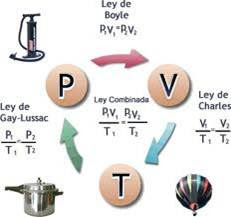
LEYES DE LOS GASES
Las principales leyes que rigen el estado
gaseoso son:
a)Ley
de Boyle – Mariotte
b)Ley
de Jacques Charles I y II
c)Ley
de Gay Lussac
d)Ley
Combinada – Ecuación general
e)Ley
de Dalton
En las leyes de los gases
intervienen 3 factores importantes que son: la presión, el volumen y la
temperatura, por lo tanto se usarán las siguientes medidas
LEY DE BOYLE – MARIOTTE
“Cuando
la temperatura permanece constante los volúmenes de los gases son inversamente
proporcionales a las presiones”, es decir si la presión aumenta, el volumen
disminuye.
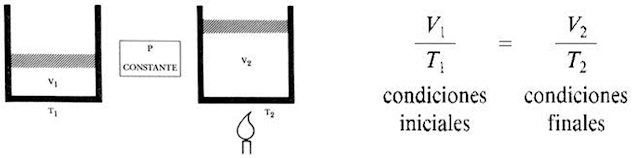
LEY DE CHARLES I
“Cuando
la presión se mantiene constante, los volúmenes de los gases son directamente
proporcionales a las temperaturas ABSOLUTAS”, es decir, que si la temperatura
aumenta, el volumen también aumenta.
Esta ley se fundamenta en que todo cuerpo por acción del calor se
dilata.
donde:
 = Volumen inicial
= Volumen inicial = Temperatura inicial
= Temperatura inicial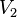 = Volumen final
= Volumen final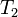 = Temperatura final
= Temperatura final
Despejando T₁ se obtiene:
Despejando T₂ se obtiene:
Despejando V₁ es igual a:
Despejando V₂ se obtiene:
Un buen experimento para demostrar esta ley es el de calentar una lata
con un poco de agua, al hervir el agua se sumerge en agua fría y su
volumen cambia.
LEY DE CHARLES II
Como
principio fundamental se tiene que una molécula de cualquier gas que se
encuentre a cero grados centígrados y una atmósfera de presión ocupa el volumen
de 22,4 litros al cual se lo llama “volumen molar”. Es necesario recordar que las masas
moleculares de las moles de los diferentes gases son diferentes pero el volumen
es igual para todos ellos.
VT=Vo (1 +∝T)
LEY DE GAY LUSSAC
“Cuando
el volumen se mantiene constante, las presiones que ejercen los gases son
directamente proporcionales a sus temperaturas ABSOLUTAS”, de manera que si la
temperatura aumenta, la presión también aumenta.
LEY COMBINADA
Tomando
en cuenta la intervención simultánea de los tres factores físicos: presión,
volumen y temperatura, es decir, combinando las tres leyes estudiadas Boyle,
Charles y Gay Lussac, se tiene la ley combinada.
ECUACIÓN GENERAL
P =
presión
V =
volumen
N =
número de moles = Pa =
(Peso en gramos del gas)
Ma
(Peso molecular del gas)
T =
Temperatura en grados Kelvin
R =
Constante universal de los gases = 0.082 at – li
mol . K
LEY DE DALTON
“La
presión total de una mezcla de dos o más gases que no reaccionan entre sí es
igual a la suma de las presiones de los componentes”
Ejercicio 20:
Si un
litro de nitrógeno encerrado en un recipiente ejerce una presión de 80 torr y
un litro de oxígeno contenido en otro recipiente ejerce una presión de 30
torr. Cuál es la presión si se mezclan
en un recipiente de un volumen total de un litro.
SOLUCIÓN:
Se denomina así a la mezcla de dos
o más componentes en cantidades fijas o no, que forman un todo homogéneo, esto
es, que no existan zonas de separación o fases.
Las soluciones se clasifican:
Diluidas: Son aquellas en las que hay muy poca cantidad de soluto disuelto, el solvente puede seguir admitiendo más soluto. Un ejemplo es la cantidad de
minerales en el agua de mesa: tiene una cantidad muy baja que nos permite
asimilarlos correctamente.
Concentradas: Son aquellas en las que hay bastante cantidad de soluto disuelto, pero el solvente todavía puede seguir admitiendo más soluto. Un ejemplo podría ser el agua
de mar: contiene una gran cantidad de sal disuelta, pero todavía sería posible
disolver más cantidad de sal.
Las soluciones se clasifican:
CONCENTRACIONES
La
concentración de las soluciones es la cantidad de soluto contenido en una
cantidad determinada de solvente o solución. Los términos diluidos o
concentrados expresan concentraciones relativas. Para expresar con exactitud la
concentración de las soluciones se usan sistemas como los siguientes:
a)Porcentaje
peso a peso (% M/M): indica
el peso de soluto por cada 100 unidades de peso de la solución.
b) Porcentaje
volumen a volumen (% V/V): se refiere al volumen de soluto por cada
100 unidades de volumen de la solución.
c) Porcentaje
peso a volumen (% P/V):
indica el número de gramos de soluto que hay en cada 100 ml de solución.
SOLUCIÓN NORMAL O NORMALIDAD (SOL.
N, N)
*Son
soluciones que contienen un equivalente químico del soluto en un volumen de
1000ml (1 L)
*El
equivalente químico (Eq) se calcula dividiendo el peso
molecular (Ma)
del soluto expresado en gramos para la valencia.
Sol. N = Eq
en 1000 ml
Eq
de H2SO4 = peso molecular 98 gramos
Eq
= 98 gr = 49 gr
2
SOLUCIÓN MOLAR O MOLARIDAD
Solución
molar (Sol. M) es aquella que tiene disuelto una mol del soluto (peso molecular
del solvente en gramos) disuelto en un volumen total de 1000 ml
Sol.
M = Ma
en 1000 ml
A diferencia de la normalidad, en
la molaridad no se divide para la valencia.
Se
derivan las siguientes fórmulas para este tipo de soluciones:
Pa= M x V x Ma M = Pa x 1000 ml
1000 ml V
x Ma
V=
Pa
x 1000 ml Ma = Pa x 1000 ml
M x Ma M
x V
MOLALIDAD
Una
solución molal (Sol. m) es aquella que contiene
una mol de soluto «más» 1000 gramos de solvente.
Pa
m= Ma Pa=
m x Pb x Ma
Pb (Kg)
Pb= peso del solvente en Kg
FRACCIÓN MOLAR
Es
una unidad química usada para expresar la concentración de soluto
en solvente.
Nos expresa la proporción en que
se encuentran los moles
de soluto con respecto a los
moles totales de solución.
Se
representa con la letra X
No
tiene unidades
*
1. Xsto
= MOLES
DE SOLUTO
MOLES DE SOLUTO +
MOLES DE DISOLVENTE
2. Xste = MOLES
DE SOLUTO
MOLES DE SOLUTO +
MOLES DE DISOLVENTE
3. Xsto + Xste = 1





















 = Volumen inicial
= Volumen inicial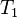 = Temperatura inicial
= Temperatura inicial